Exigências regulatórias para estudos não-clínicos de segurança de medicamentos fitoterápicos
Embora o desenvolvimento de novos medicamentos seja um processo desafiador e repleto de riscos, a clareza sobre as regras e expectativas regulatórias pode tornar essa jornada um pouco mais acessível.
BLOG CIENP
Guilherme P. Fadanni, PhD, João B. Calixto, PhD
11/22/20248 min read
Recentemente, em outubro de 2024, publicamos um texto sobre o desenvolvimento de medicamentos a partir de plantas medicinais no Brasil, no qual discutimos aspectos conceituais e estruturais relevantes à área. Caso você ainda não tenha lido essa primeira parte e tenha interesse, clique aqui. Hoje, em continuação, abordaremos especificamente a questão dos estudos não-clínicos de segurança de novos fitoterápicos, destacando pontos importantes das diretrizes regulatórias atualmente vigentes no nosso país.
O desenvolvimento de medicamentos fitoterápicos sempre foi e continuará sendo de grande importância global na farmacoterapia, mas enfrenta desafios, como já destacamos anteriormente. Um dos desafios é o fato de que as exigências regulatórias da etapa não-clínica de fitoterápicos são variáveis entre diferentes países e agências, o que reduz a previsibilidade, a celeridade e o interesse do setor produtivo em projetos de inovação radical na área. Inclusive, isso é de certa forma contrastante com a pesquisa e desenvolvimento (P&D) de novos medicamentos sintéticos e alguns biológicos, que tende a ter maior harmonização internacional em razão da publicação do guia ICH M3 (R2) - Non-clinical safety studies for the conduct of human clinical trials for pharmaceuticals em 2009. Já na esfera nacional, uma representação combinada desta e de outras diretrizes foi publicada em 2013 pela ANVISA e intitulada “Guia para a Condução de Estudos Não Clínicos de Toxicologia e Segurança Farmacológica Necessários ao Desenvolvimento de Medicamentos” (Figura 1), trazendo maior amparo ao cenário interno. Embora seja naturalmente e por muitas razões um negócio de risco, o complicado processo de levar um novo medicamento ao mercado se torna um pouco menos desafiador quando há clareza nas regras e expectativas.




Figura 1. Guia ICH M3 (R2) e guia geral da ANVISA sobre estudos não-clínicos para o desenvolvimento de medicamentos.
Sendo de extrema importância, esses guias constituem recomendações gerais e multidisciplinares (por isso o “M” do guia ICH) que devem ser consideradas em paralelo aos guias temáticos específicos, focados em qualidade (série “Q”) e segurança (série “S”). Todavia, o entendimento comum é de que ambos o guia ICH M3 (R2) e o guia da ANVISA citado acima são mais pertinentes às pequenas moléculas (do inglês “small molecules”, termo utilizado para moléculas orgânicas de origem sintética e de baixo peso molecular), cujo arcabouço regulatório vem sendo construído e aprimorado com mais intensidade e há muito mais tempo do que para fitoterápicos. Embora muitos conceitos de segurança não-clínica sejam aplicáveis a diferentes classes terapêuticas, os fitoterápicos apresentam características únicas: a) são caracterizados por uma sinfonia de moléculas naturais ao invés de uma única molécula sintética com estrutura química e atividade farmacológica bem definidas; e b) a origem vegetal da matéria-prima está intrinsecamente ligada a sistemas vivos complexos, os quais estão expostos a variáveis menos controláveis em comparação com os processos baseados em síntese orgânica. Logo, somados esses e outros fatores, é razoável que o desenvolvimento não-clínico de novos fitoterápicos, assim como o de anticorpos monoclonais, vacinas, terapias avançadas e outras tantas modalidades terapêuticas, necessite de algum nível de ajuste, adição e/ou isenção em relação ao “padrão” estabelecido para sintéticos.
No Brasil, a base regulatória para registro de medicamentos fitoterápicos é a Resolução da Diretoria Colegiada (RDC) n° 26, de 13 de maio de 2014, que, justamente, “dispõe sobre o registro de medicamentos fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos“. A RDC foi acompanhada da Instrução Normativa (IN) n° 04, de 18 de junho de 2014, que no âmbito de estudos não-clínicos recomendava a utilização do guia de 2013 da ANVISA “no que for aplicável a medicamentos fitoterápicos” ou de estratégias alternativas, mas sem fornecer maiores detalhes. Por conseguinte, dada a necessidade de orientação mais específica, a ANVISA realizou um estudo de comparação de guias nacionais e internacionais a fim de identificar como e quais orientações existentes de fato se aplicariam aos fitoterápicos. O resultado desta iniciativa foi o guia n° 22/2019 da ANVISA intitulado “Estudos Não-Clínicos Necessários ao Desenvolvimento de Medicamentos Fitoterápicos e Produtos Tradicionais Fitoterápicos” (Figura 2), discutido mais a fundo a seguir.


Figura 2. Guia n° 22/2019 da ANVISA, sobre estudos não-clínicos para desenvolvimento de medicamentos fitoterápicos e produtos tradicionais fitoterápicos.
Antes mesmo de entrar em detalhes, é preciso esclarecer alguns pontos. Primeiro, medicamentos cuja composição contém substâncias ativas naturais isoladas e/ou altamente purificadas não são considerados fitoterápicos. Esses, entre outros casos, são classificados como medicamentos específicos (dispostos na RDC 24/2011), cujos ensaios não-clínicos — de acordo com o próprio guia de fitoterápicos n° 22/2019 da ANVISA — “devem seguir o guia de desenvolvimento não-clínico de medicamentos sintéticos (...)”. Um segundo ponto é que fitoterápicos desenvolvidos a partir de espécies vegetais com registro simplificado não precisam apresentar estudos não-clínicos, conforme a IN 04/24. Por fim, destaca-se que o guia não-clínico de fitoterápicos parte da premissa de que “(...) nem todos os testes não-clínicos exigidos na versão de 2013 do guia de sintéticos e biológicos da ANVISA seriam necessários ao desenvolvimento de fitoterápicos”. Por isso, logo no início, a agência apresenta um quadro comparativo no qual descreve “testes recomendados” e “testes que poderão ser recomendados de acordo com os dados da literatura”, além de fazer distinção dos testes entre as categorias “medicamento fitoterápico” e “produto tradicional fitoterápico” (Figura 3).
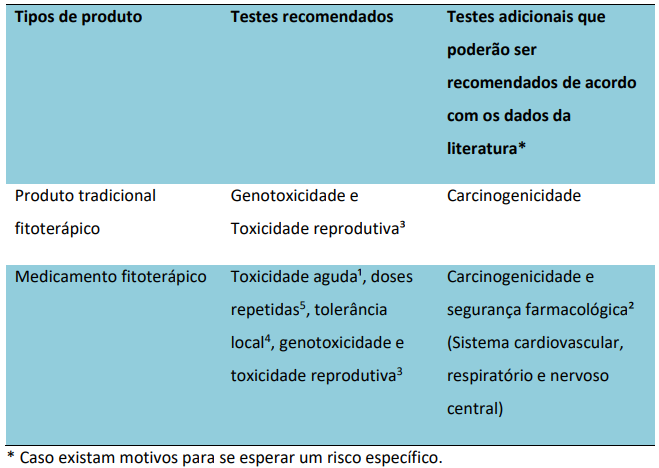
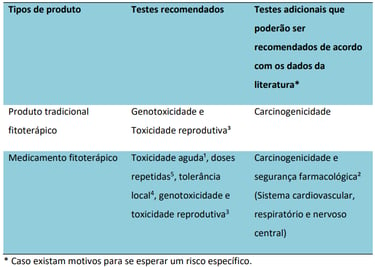
Figura 3. Estudos não-clínicos para o desenvolvimento de medicamentos fitoterápicos e produtos tradicionais fitoterápicos, conforme guia n° 22/2019 da ANVISA. As notas de rodapé podem ser consultadas diretamente no guia.
Com base nessas informações, fica evidente que os produtos tradicionais fitoterápicos possuem um nível de exigência bem menor, limitado a testes de genotoxicidade, toxicidade reprodutiva e do desenvolvimento e, em casos bastante específicos, carcinogenicidade. Vale lembrar que esta categoria requer a comprovação da tradicionalidade de uso e o cumprimento de diversos critérios (vide art. 23 da RDC 26/2014), que não serão abordados aqui. Para medicamentos fitoterápicos, por sua vez, são recomendados os estudos de toxicidade aguda e de doses repetidas, tolerância local, genotoxicidade e de toxicidade reprodutiva e do desenvolvimento, deixando os estudos de carcinogenicidade e de farmacologia de segurança para quando há razão que justifique a realização dos mesmos. Sendo assim, se compararmos as principais recomendações do guia geral da ANVISA com as do guia de fitoterápicos, temos os seguintes pontos de importância:
Estudos de toxicidade geral aguda, subcrônica e/ou crônica, conforme aplicável: permanece a exigência de duas espécies (roedora e não-roedora), porém a toxicologia aguda com fitoterápicos poderá ser realizada com uma única via de administração, ao invés de duas (i.e., pretendida + parenteral). Vale lembrar que, por questão de eficiência e redução de uso de animais, as avaliações de tolerância local e toxicocinética são geralmente realizadas como parte de um mesmo estudo de toxicidade geral;
Estudos de genotoxicidade: ao invés das duas opções de baterias de testes comumente utilizadas para pequenas moléculas, o guia 22/2019 recomenda a utilização de uma árvore decisória, que abre a possibilidade para a suficiência do teste de AMES quando este for negativo;
Estudos de farmacologia de segurança (respiratória, cardiovascular e do sistema nervoso central): estão dispensados para o desenvolvimento de fitoterápicos, exceto quando houver razão que justifique a realização. Este é um ponto de grande contraste com outras classes terapêuticas, que comumente precisam ter as avaliações da farmacologia de segurança realizadas antes da anuência ao estudo clínico de fase I;
Estudos de toxicidade reprodutiva e do desenvolvimento: embora sejam recomendados independentemente se um ativo é classificado como fitoterápico ou não, as três diretrizes regulatórias aqui citadas preveem mecanismos para isentar ou adiar um ou mais estudos, de acordo com o cumprimento de condições (vide ICH M3 [R2] e guia de 2013 da ANVISA). Contudo, a possibilidade de isenção está mais acessível para fitoterápicos segundo o guia 22/2019, o qual prevê a substituição desses estudos (quando na ausência de justificativa para realizá-los) por uma inserção em bula que destaca a contraindicação do uso em mulheres grávidas ou lactantes;
Estudos de carcinogenicidade: só precisam ser realizados com fitoterápicos quando houver razão específica para preocupação, como dados da literatura que indiquem potencial carcinogênico ou resultado positivo na avaliação de genotoxicidade.
Por fim, há dois pontos restantes a discutir. Primeiro, todas as diretrizes citadas solicitam que os testes de segurança definitivos sejam realizados em conformidade com os Princípios das Boas Práticas de Laboratório (BPL). Já publicamos um texto específico sobre esse assunto, que você pode acessar clicando aqui. Em resumo, no Brasil, ter conformidade BPL significa que os testes em questão foram realizados por uma instituição certificada pelo INMETRO quanto à sua conformidade com a norma para estes mesmos testes. Isso inclui um processo complexo de auditoria e monitoramento da infraestrutura, capacidade técnica, fornecedores e diversos outros aspectos, além da verificação prévia da capacidade de execução e controle de qualidade nos testes específicos que receberam o selo BPL. Em um segundo ponto, o leitor deve lembrar que a discussão deste texto tem foco no cenário regulatório brasileiro. Porém, se é um objetivo do projeto registrar o medicamento em vários países, é recomendado também considerar as diretrizes regulatórias de outras agências. Neste caso, uma das principais referências é o guia de 2016 da Food and Drug Administration (FDA) intitulado “Botanical Drug Development – Guidance for Industry”, o qual é notavelmente exigente.
Referências
ANVISA. Guia para a Condução de Estudos Não Clínicos de Toxicologia e Segurança Farmacológica Necessários ao Desenvolvimento de Medicamentos - Versão 2. 2013. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/medicamentos/pesquisa-clinica/manuais-e-guias/guia-para-a-conducao-de-estudos-nao-clinicos-de-toxicologia-e-seguranca-farmacologica-necessarios-ao-desenvolvimento-de-medicamentos-versao-2.pdf/view
ANVISA. Guia n° 22/2019 - Estudos não-clínicos necessários ao desenvolvimento de medicamentos fitoterápicos e produtos tradicionais fitoterápicos. 2019. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/medicamentos/pesquisa-clinica/manuais-e-guias/guia-22_estudos-nao-clinicos-fitoterapicos.pdf/view
ANVISA. RDC n° 26/2014 - https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2014/rdc0026_13_05_2014.pdf
ANVISA. IN n° 04/2014 - https://www.gov.br/anvisa/pt-br/setorregulado/regularizacao/medicamentos/fitoterapicos-dinamizados-e-especificos/informes/fitoterapicos/in-04-2014.pdf
ANVISA. RDC n° 24/2011 - https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2011/rdc0024_14_06_2011.pdf
FDA. Botanical Drug Development - Guidance for Industry. 2016. Disponível em: https://www.fda.gov/media/93113/download
ICH M3 (R2) - Non-clinical safety studies for the conduct of human clinical trials for pharmaceuticals. 2009. Disponível em: https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-m3r2-non-clinical-safety-studies-conduct-human-clinical-trials-and-marketing-authorisation-pharmaceuticals-step-5_en.pdf
Endereço
Av. Luiz Boiteaux Piazza, 1302 - Sapiens Parque, Cachoeira do Bom Jesus, Florianópolis, Santa Catarina, Brasil.
Segunda a sexta-feira das 08:00 às 17:00 horas.
©2024 - Centro de Inovação e Ensaios Pré-Clínicos
Mapa do site
Serviços
+55 (48) 3332-8400
contato@cienp.org.br
