Plantas medicinais e novos medicamentos no Brasil
Apesar da enorme biodiversidade e das oportunidades que ela oferece, desafios legais e de infraestrutura dificultam a transformação da riqueza biológica em inovação farmacêutica genuinamente brasileira.
BLOG CIENP
Guilherme P. Fadanni, PhD, João B. Calixto, PhD
10/7/20246 min read


Desde os tempos antigos, plantas medicinais têm sido amplamente utilizadas para tratar diferentes condições. Dois exemplos bastante difundidos são a papoula (Papaver somniferum) e a maconha (Cannabis sativa), que já eram usadas há mais de 4.000 anos para diferentes tipos de dores e desconfortos. No entanto, foi no final do século XVIII e início do século XIX que os avanços científicos trouxeram um novo entendimento sobre a importância e o potencial de plantas com propriedades terapêuticas. Entre 1803 e 1817, o farmacêutico alemão Friedrich Sertürner conseguiu isolar da papoula pela primeira vez a morfina, feito que desencadeou uma busca contínua por substâncias derivadas de plantas. Pouco tempo depois, em 1824, Pierre-Jean Robiquet isolou o agente antitussígeno codeína, também da papoula, e em 1848, George Merck Fraz isolou da mesma planta o antiespasmódico papaverina. Ao longo das décadas seguintes e até hoje, diversas plantas foram estudadas e ativos importantes foram sendo isolados, como atropina, cafeína, digoxina, pilocarpina, galantamina, paclitaxel, entre vários outros. Notavelmente, um dos marcos históricos no desenvolvimento da indústria farmacêutica moderna foi a descoberta da salicina por Rafaele Pina, em 1832, a partir do salgueiro (Salix alba). Em 1839, realizou-se a primeira modificação estrutural da salicina, resultando no ácido salicílico. Quase seis décadas depois, em 1897, um químico da Bayer modificou o ácido salicílico para criar o ácido acetilsalicílico, posteriormente patenteado em 1899 e nomeado aspirina.
Em razão da variedade de suas aplicações e de seus constituintes, plantas medicinais foram e continuam sendo um recurso extremamente importante no processo de desenvolvimento de medicamentos. Elas podem ser usadas como uma fonte direta de agentes terapêuticos, seja na forma de extratos complexos ou fármacos isolados como citado acima, e de matéria-prima para o desenvolvimento de drogas semissintéticas. Além disso, servem como fonte de protótipos para o desenho de novas moléculas e como marcadores taxonômicos para a descoberta de novos fármacos.
Quando falamos de Brasil, especificamente, há alguns pontos importantes a discutir. O Brasil é o país com a maior biodiversidade do mundo, com mais de 116 mil espécies animais e 46 mil espécies vegetais conhecidas e espalhadas pelos seis biomas terrestres e três grandes ecossistemas marinhos. Esses números correspondem a cerca de 20% do total de espécies do planeta, tamanha é a representatividade brasileira. Em toda essa abundância, e particularmente nas espécies vegetais, reside um potencial enorme de descoberta e desenvolvimento de novos medicamentos. Contudo, ainda que o número de artigos científicos brasileiros com plantas medicinais seja bastante significativo (na ordem de milhares ao ano) e crescente, o número de medicamentos inovadores desenvolvidos localmente e derivados de plantas da nossa biodiversidade é tão pequeno que cabe nas mãos. Inequivocamente, há várias razões para a atual discrepância, incluindo-se as múltiplas limitações em identificar, acessar, estudar, proteger, produzir, desenvolver, escalonar, registrar e regular os medicamentos à base de plantas, além de aspectos relacionados a lacunas na infraestrutura da cadeia de inovação radical em medicamentos, know-how e políticas públicas.
Há também que se mencionar diretamente as dificuldades com regras e condições de acesso ao patrimônio genético brasileiro. Embora progresso tenha sido feito com a aprovação da Lei 13.123/2015, chamada Lei da Biodiversidade, décadas de discussão foram ainda insuficientes para prover segurança jurídica plena aos agentes interessados no processo de inovação. De uma maneira geral, isso se deve ao fato de que restam "áreas cinzentas" na legislação, que atuam como um desestímulo à exploração da biodiversidade e, posteriormente, à proteção das invenções. Na prática, enquanto cientistas e indústrias brasileiras sofrem para avançar em seus projetos, muitas espécies foram extintas ou encaminham-se à extinção, e pesquisadores estrangeiros continuam estudando nossa natureza.
De maneira interessante, um levantamento de 2018 cita 876 depósitos de pedidos de patentes entre 1995 e 2017 no INPI que estão relacionados a fitoterápicos e que tenham sido realizados com a prioridade de publicação no Brasil, sendo 377 atribuídos a inventores independentes, 147 a empresas e 257 a universidades (Figura 1). Outros 1106 pedidos (55,6%) são de prioridade não-brasileira, ou seja, oriundos de outros países. Considerados somente os pedidos com prioridade brasileira, 59,6% foram indeferidos ou arquivados, e apenas 12 patentes (1,3%) foram concedidas até a data do estudo. Esses dados mostram não somente que a taxa de concessão de patentes foi baixíssima no período, mas também que obter a proteção da propriedade intelectual não garante continuidade do desenvolvimento e tampouco o acesso ao consumidor, visto que não foram encontrados produtos no mercado que estejam atribuídos às patentes concedidas. Além disso, é alarmante que o tempo médio de concessão das patentes tenha sido maior do que 11 anos, período pelo qual ficam prejudicadas as negociações de transferência de tecnologia (e, por consequência, o avanço ao mercado) em razão do risco de se ter apenas a expectativa da proteção, e não a garantia.
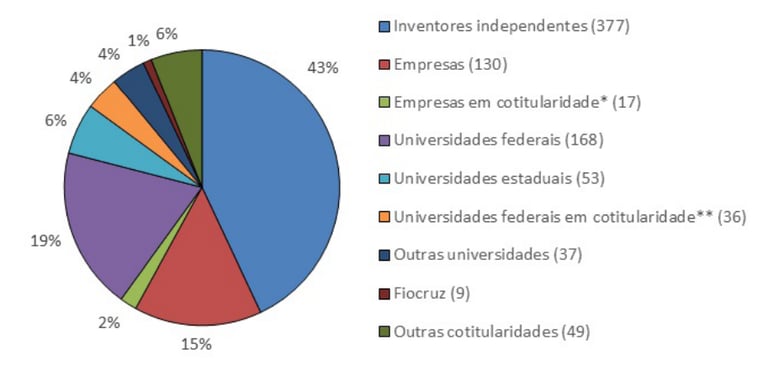
Figura 1. Perfil dos depositantes de pedidos de patentes no INPI nas classes a61k36/... ou a61k35/78, com prioridade BR durante o período de 1995 a 2017. Fonte: de França & Vasconcellos (2018).
Considerado o histórico recente, continua sendo o Acheflan® o principal caso de sucesso de medicamento fitoterápico brasileiro, embora registrado há mais de 20 anos na ANVISA. Com estudos iniciados em 1998 a partir da Cordia verbenacea, o produto surgiu de pesquisa e desenvolvimento (P&D) puramente nacional e foi registrado em 2004, sustentando até hoje a liderança em prescrições e sendo comercializado em vários países. Orgulhosamente, os estudos pré-clínicos de eficácia e segurança que deram suporte ao desenvolvimento do medicamento são frutos da participação direta de pesquisadores que hoje compõem a equipe do CIEnP.
Por fim, ao se observar o cenário atual no Brasil, é evidente que, apesar da biodiversidade abundante e alguns avanços tecnológicos e regulatórios, o Brasil continua sendo pouco proficiente na exploração das oportunidades que sua natureza oferece. Isso é particularmente contraditório quando considerado o sólido uso tradicional de plantas medicinais pela população brasileira, bem como a grande aceitação ao uso de medicamentos fitoterápicos, o que gera um mercado fértil para novos produtos. Ainda assim, entre os medicamentos fitoterápicos mais prescritos no mercado brasileiro, a vasta maioria é derivada de P&D estrangeiro e dependente da importação do produto acabado ou de matéria-prima para fabricação local, o que só contribui para a já problemática dependência brasileira da importação de insumos farmacêuticos. Por isso, é de extrema importância a criação de políticas públicas de incentivo ao desenvolvimento de medicamentos derivados da biodiversidade nacional, além da formação de pessoal qualificado para atuar nas diferentes etapas da cadeia. Tais etapas envolvem desde a pesquisa básica e a identificação de espécies com potencial terapêutico (etnofarmacologia) até o registro e farmacovigilância do medicamento industrializado, passando pela caracterização, produção, controle de qualidade, pesquisa não-clínica, pesquisa clínica e conformidade regulatória.
No momento da publicação deste texto, o CIEnP possui em seu portfólio 7 projetos de desenvolvimento ou co-desenvolvimento pré-clínico de medicamentos fitoterápicos, sendo que 5 estão finalizados ou em fase final de estudos regulatórios, além de um fitocosmético já transferido à indústria e disponível no mercado.
Referências:
Calixto, J. B. Efficacy, safety, quality control, marketing and regulatory guidelines for herbal medicines (phytotherapeutic agents).Brazilian Journal of Medical and Biological Research, v. 33, n. 2, p. 179-189. 2000. Disponível em: https://www.scielo.br/j/bjmbr/a/cdFtQgSkR4tybYxnsLWZ7Nr/?lang=en.
Calixto, J. B. Biodiversidade como fonte de medicamentos. Ciência e Cultura, v. 55, n. 3. 2003. Disponível em: http://cienciaecultura.bvs.br/scielo.php?script=sci_arttext&pid=S0009-67252003000300022
Calixto J. B. The role of natural products in modern drug discovery. Anais Da Academia Brasileira de Ciências, 91(suppl 3). 2019. Disponível em: https://www.scielo.br/j/aabc/a/54VqS5XW6hVC6LYsjWmC5qC/.
Dutra, R. C.; Campos, M. M.; Santos, A. R. S.; Calixto, J. B. Medicinal plants in Brazil: Pharmacological studies, drug discovery, challenges and perspectives. Pharmacological Research, 112, 4–29. 2016. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26812486/
de França, E.; Vasconcellos, A. G. Patentes de fitoterápicos no Brasil: uma análise do andamento dos pedidos no período de 1995-2017. Cadernos de Ciência & Tecnologia, Brasília, v. 35, n. 3, p. 329-359. 2018. Disponível em: https://ainfo.cnptia.embrapa.br/digital/bitstream/item/189645/1/Patentes-de-fitoterapicos-no-Brasil.pdf.
Endereço
Av. Luiz Boiteaux Piazza, 1302 - Sapiens Parque, Cachoeira do Bom Jesus, Florianópolis, Santa Catarina, Brasil.
Segunda a sexta-feira das 08:00 às 17:00 horas.
©2024 - Centro de Inovação e Ensaios Pré-Clínicos
Mapa do site
Serviços
+55 (48) 3332-8400
contato@cienp.org.br
