Terapia celular personalizada pode mudar o futuro do tratamento das doenças autoimunes
AVANÇOS CIENTÍFICOS EM FOCO
Sara Tolouei, PhD; Fabiana C. V. Giusti, PhD e João B. Calixto, PhD
10/23/20252 min read
Pesquisadores liderados pelo imunologista japonês e Prêmio Nobel de Fisiologia ou Medicina de 2025, Shimon Sakaguchi, e por Masayuki Amagai, da Keio University School of Medicine (Shinjuku-ku, Tóquio), apresentaram um avanço promissor para o desenvolvimento de uma terapia celular voltada ao tratamento de doenças autoimunes, em dois artigos complementares publicados na revista Science Translational Medicine (22 de outubro de 2025). As descobertas representam um passo importante rumo ao desenvolvimento de novos tratamentos personalizados, capazes de suprimir respostas imunológicas destrutivas sem comprometer a defesa natural do organismo.
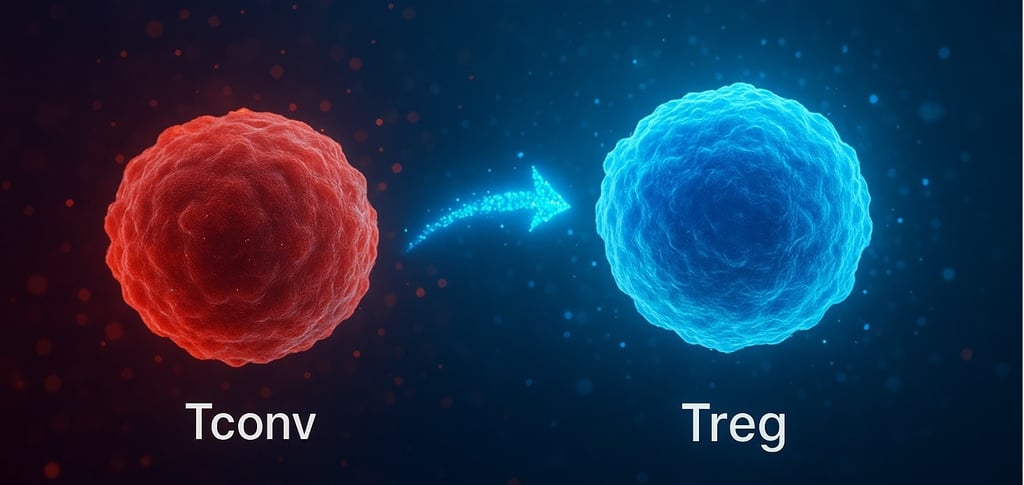
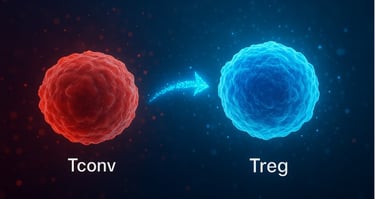
O grupo liderado por Sakaguchi desenvolveu uma nova estratégia para converter células T convencionais (Tconv) — normalmente responsáveis por atacar microrganismos — em células T regulatórias (Treg), que atuam como “freios” do sistema imune, impedindo que ele ataque tecidos saudáveis. O grande desafio até então era produzir Tregs em quantidade suficiente e que permanecessem estáveis no corpo. Utilizando uma combinação inovadora de moléculas sinalizadoras, inibidores de CDK8/19 e privação de coestimulação CD28, os pesquisadores conseguiram gerar células Treg induzidas estáveis e funcionais (S/F-iTreg), com alta expressão do gene Foxp3 — essencial para sua ação reguladora — e modificações epigenéticas que prolongam sua estabilidade.
Nos testes realizados em modelos animais, essas novas células Tregs mostraram-se capazes de controlar doenças inflamatórias intestinais e a rejeição de enxertos (doença do enxerto contra o hospedeiro) por várias semanas, mantendo o perfil imunossupressor sem perda de função.
Em um segundo estudo, liderado por Amagai, a mesma estratégia foi aplicada ao pênfigo vulgar, uma grave doença autoimune da pele causada por autoanticorpos contra a proteína desmogleína-3. As células T patogênicas específicas para esse antígeno foram reprogramadas em Tregs igualmente específicas, que bloquearam seletivamente a produção de autoanticorpos e reduziram as lesões cutâneas em camundongos, sem causar imunossupressão sistêmica. Além disso, os cientistas demonstraram que células humanas de pacientes com pênfigo também podem ser convertidas com sucesso em laboratório, abrindo caminho para futuros ensaios clínicos.
Essas descobertas consolidam uma nova abordagem para reprogramar células T patogênicas em células regulatórias específicas de antígeno, oferecendo uma estratégia inovadora, potencialmente segura, duradoura e personalizada para o tratamento de múltiplas doenças autoimunes.
Endereço
Av. Luiz Boiteaux Piazza, 1302 - Sapiens Parque, Cachoeira do Bom Jesus, Florianópolis, Santa Catarina, Brasil.
Segunda a sexta-feira das 08:00 às 17:00 horas.
©2024 - Centro de Inovação e Ensaios Pré-Clínicos
Mapa do site
Serviços
+55 (48) 3332-8400
contato@cienp.org.br
