Papel dos Estudos Pré-Clínicos na Translação das Terapias Avançadas
As terapias avançadas, como as gênicas, celulares e de engenharia tecidual, representam uma das maiores promessas da medicina contemporânea, mas também trazem desafios inéditos. Do uso de modelos animais e organoides à interação com órgãos reguladores, os estudos pré-clínicos desempenham papel central na avaliação de segurança, eficácia e viabilidade, definindo se uma inovação científica poderá ou não chegar aos pacientes.
Fabiana C. V. Giusti, PhD; Sara Tolouei, PhD e João B. Calixto, PhD
10/6/20256 min read
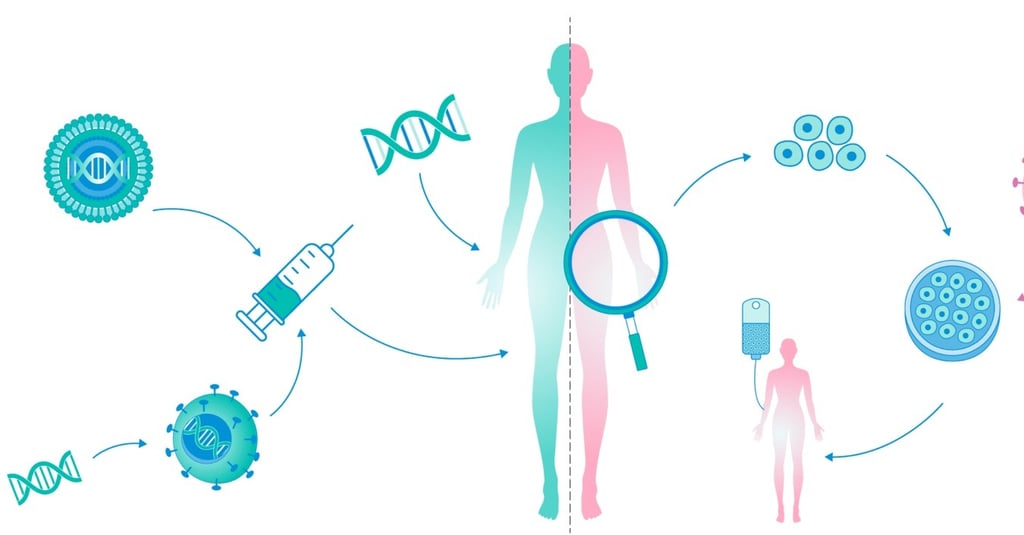
Modelos experimentais e complexidade biológica
O desenvolvimento pré-clínico de terapias avançadas - incluindo terapias gênicas, celulares e produtos de engenharia tecidual - envolve desafios que superam os enfrentados em medicamentos convencionais. O caráter altamente individualizado desses produtos, aliado ao uso de plataformas de grande complexidade e inovadoras, demandam planejamento experimental detalhado, monitoramento rigoroso e interação precoce com agências regulatórias e, em muitas situações a necessidade de animais transgênicos (humanizados).
A escolha de modelos experimentais adequados é essencial para garantir relevância biológica, segurança e a possibilidade de translação para a clínica. Modelos animais geneticamente modificados, como por exemplo os camundongos SMNΔ7 utilizados nos produtos destinados ao tratamento da atrofia muscular espinhal (AME), permitem investigar mecanismos de doença, eficácia terapêutica e toxicidade. Contudo, diferenças metabólicas e complexidade imunológica limitam a extrapolação para humanos. Por isso, modelos de grande porte, como suínos e primatas não humanos, embora muito onerosos, poderão ser necessários para avaliar a biodistribuição, a imunogenicidade e a toxicidade de longo prazo.
Paralelamente, avanços em modelos in vitro ampliam a previsibilidade dos resultados em seres humanos. Os organoides derivados de células-tronco pluripotentes são outra estratégia recentemente utilizada com sucesso, pois são capazes de reproduzirem arquiteturas tridimensionais de tecidos humanos, preservando assim as interações celulares e o microambiente. Já os sistemas microfluídicos (organs-on-a-chip), também de grande relevância na análise pré-clínica, simulam o fluxo sanguíneo e a comunicação intertecidual, permitindo que os estudos de toxicidade (segurança), biodistribuição e de mecanismo de ação possam ser realizados com maior precisão e acurácia. Essas plataformas não apenas reduzem a dependência do uso de animais, como também aceleram o processo da triagem de candidatos terapêuticos para terapias avançadas
Apesar de sua relevância translacional, todos esses modelos discutidos apresentam custos significativamente elevados. O uso de primatas não humanos ou de sistemas de microfluídicos avançados, por exemplo, pode representar investimento substancial, tornando necessária uma avaliação criteriosa entre ganho científico e viabilidade econômica. Assim, a seleção do modelo pré-clínico não depende apenas da relevância biológica, mas também do equilíbrio entre previsibilidade e sustentabilidade financeira do projeto.
Biodistribuição, expressão e durabilidade da resposta terapêutica
A avaliação de biodistribuição dos produtos de terapias avançadas constitui o eixo central da avaliação pré-clínica, pois define o local de ação do candidato a medicamento, a duração do seu efeito e, mais importante, possíveis expressões fora do alvo terapêutico. Em terapias gênicas, a quantificação do transgene pode ser realizada por PCR quantitativo, Northern/Western blot, imunohistoquímica e técnicas de imagem molecular. Já para as terapias celulares, técnicas como rastreamento genético, bioluminescência e imagem 3D permitem monitorar a migração, a integração e a durabilidade da resposta terapêutica das células transplantadas.
Esses estudos também são cruciais para identificar potenciais efeitos adversos, como por exemplo, a expressão de células em tecidos não-alvo ou a indução de respostas imunológicas indesejadas. Esses estudos se bem conduzidos podem contribuir para subsidiar decisões sobre a escolha da dose ótima, a frequência de administração bem como as estratégias de mitigação de risco antes da fase clínica.
Segurança e avaliação de riscos
As terapias avançadas apresentam riscos complexos que exigem avaliações cuidadosas e integradas. Entre os principais pontos estão:
Efeitos off-target e mutagênese: técnicas de sequenciamento genômico, análise de hotspots e CRISPR-seq são aplicadas para identificar inserções não intencionais e prever potenciais riscos de oncogenicidade;
Imunogenicidade: vetores virais e células transplantadas podem gerar respostas adversas. As análises de segurança incluem avaliar os anticorpos neutralizantes, perfis de citocinas, ativação de células T, além de inflamação tecidual;
Transmissão germinativa: vetores que atingem células germinativas representam potenciais risco hereditário. Por isso, são realizados ensaios em modelos de reprodução e testes de transgene em gônadas (órgãos reprodutores);
Alterações fenotípicas inesperadas: células manipuladas ex vivo podem sofrer mudanças em suas expressões gênicas ou nas suas funções. Ensaios de caracterização celular, incluindo análise por transcriptômica e proteômica são fundamentais para detectar potenciais alterações.
Interação com agências reguladoras
Devido ao caráter de inovação disruptiva e da complexidade desses produtos, a interação precoce com órgãos reguladores - como FDA, EMA e Anvisa - é altamente recomendada e também necessária. Reuniões pré-submissão permitem discutir seleção de doses, endpoints de segurança, critérios de biodistribuição, bem como estratégias de monitoramento clínico. Esse diálogo regulatório facilita decisões baseadas em risco, otimizando esforços em aspectos críticos para segurança do paciente e viabilidade técnica do produto, além de contribuir para evitar a perda de tempo e de recursos financeiros.
Estudos de eficácia pré-clínica
A demonstração de eficácia (prova de conceito) é requisito essencial para qualquer candidato a medicamento antes da transição clínica. Ensaios pré-clínicos devem oferecer prova de conceito robusta, estabelecer claras relações dose-resposta e comprovar reprodutibilidade entre diferentes lotes, linhagens celulares e/ou vetores.
Em terapias gênicas, além do ganho funcional, mede-se a expressão da proteína terapêutica em tecidos-alvo. Em terapias celulares, avaliam-se integração, sobrevivência, manutenção da viabilidade e a função no hospedeiro. O uso de biomarcadores permite correlacionar dose e efeito terapêutico, antecipar potenciais resultados clínicos e aumentar substancialmente as chances sucesso no desenvolvimento clínico. Organoides e sistemas microfluídicos também podem validar mecanismos de ação e ainda contribuir para revelar efeitos adversos em múltiplos tecidos.
Avanços pré-clínicos recentes
Nos últimos anos, avanços significativos têm ampliado a previsibilidade dos estudos de desenvolvimento de medicamentos para terapias avançadas:
Vetores virais de nova geração: possibilitam maior eficiência de entrega, redução da imunogenicidade e expressão prolongada do transgene;
Edição genética de precisão: técnicas como CRISPR/Cas9, base editors e prime editors vêm sendo aplicados com sucesso em modelos animais com menor risco de efeitos off-target;
Terapias celulares rastreáveis: técnicas de imagem celular e marcação genética permitem monitorar migração, integração e viabilidade em tempo real;
Modelos in vitro avançados: o uso de organoides, co-culturas 3D e organ-on-a-chip simulam microambientes humanos, aumentando substancialmente a previsibilidade da resposta terapêutica;
Análises multi-ômicas: a integração de tecnologias de transcriptômica, proteômica e metabolômica auxilia na detecção precoce de efeitos adversos e contribui na compreensão das respostas celulares.
Os empregos dessas inovações consolidam a fase pré-clínica como etapa estratégica, reduzindo incertezas, riscos e principalmente acelerando o desenvolvimento clínico de terapias inovadoras.
Considerações finais
Como discutido acima, o desenvolvimento pré-clínico para desenvolvimento de terapias avançadas requer uma abordagem multidimensional, centrada na avaliação de risco e no alinhamento regulatório. A seleção criteriosa de modelos experimentais, a caracterização detalhada de biodistribuição e durabilidade da resposta terapêutica, a avaliação ampla de segurança e a definição de parâmetros robustos de eficácia são passos cruciais para reduzir incertezas, riscos e, sobretudo, para facilitar com sucesso a transição para os estudos clínicos.
Além das complexidades e dos requerimentos técnicos e regulatórios, o custo elevado dos modelos pré-clínicos para as chamadas terapias avançadas constitui um desafio adicional. A escolha de abordagens inovadoras precisa considerar não apenas a robustez científica, mas também a viabilidade financeira e estratégica, uma vez que terapias avançadas já demandam investimentos expressivos em desenvolvimento, produção e escalabilidade.
Os avanços recentes incluindo vetores otimizados, edição genética de alta precisão, terapias celulares rastreáveis e modelos in vitro sofisticados, demonstram que dados pré-clínicos robustos são fundamentais para decisões regulatórias consistentes e para o sucesso do desenvolvimento clínico. Mesmo diante de enormes desafios, as terapias avançadas vêm se consolidando como uma das fronteiras mais promissoras da medicina contemporânea, capazes de tratar e até curar doenças antes consideradas intratáveis. O maior obstáculo, no entanto, permanece sendo a viabilidade de acesso, uma vez que os custos extremamente elevados ainda limitam sua disponibilização em larga escala.
Referências:
European Medicines Agency (EMA). Guideline on quality, non-clinical and clinical aspects of gene therapy medicinal products. EMA/CHMP/GTWP/671639/2008. Disponível em:
U.S. Food and Drug Administration (FDA). Considerations for the Design of Early-Phase Clinical Trials of Cellular and Gene Therapy Products. Guidance for Industry. 2015. Disponível em: https://www.fda.gov/media/106369/download
International Council for Harmonisation (ICH). S12 Nonclinical Biodistribution Considerations for Gene Therapy Products. 2022. Disponível em:
https://database.ich.org/sites/default/files/ICH_S12_Step4_Guideline_2023_0314.pdf
High KA, Roncarolo MG. Gene therapy. New England Journal of Medicine. 2019;381:455-464. Disponível em: https://www.nejm.org/doi/full/10.1056/NEJMra1706910
Hanna E, Rémuzat C, Auquier P, Toumi M. Advanced therapy medicinal products: current and future perspectives. Journal of Market Access & Health Policy. 2016;4:31036. Disponível em:
https://www.tandfonline.com/doi/full/10.3402/jmahp.v4.31036
Pimenta C, Bettiol V, Alencar-Silva T, Franco OL, Pogue R, Carvalho JL, Felipe MSS. Advanced Therapies and Regulatory Framework in Different Areas of the Globe: Past, Present, and Future. Clin Ther. 2021 May;43(5):e103-e138. doi: 10.1016/j.clinthera.2021.02.006.
Schambach A, Buchholz CJ, Torres-Ruiz R, Cichutek K, Morgan M, Trapani I, Büning H. A new age of precision gene therapy. Lancet. 2024 Feb 10;403(10426):568-582. doi: 10.1016/S0140-6736(23)01952-9.
Endereço
Av. Luiz Boiteaux Piazza, 1302 - Sapiens Parque, Cachoeira do Bom Jesus, Florianópolis, Santa Catarina, Brasil.
Segunda a sexta-feira das 08:00 às 17:00 horas.
©2024 - Centro de Inovação e Ensaios Pré-Clínicos
Mapa do site
Serviços
+55 (48) 3332-8400
contato@cienp.org.br
