Medicamentos aprovados em 2024: avanços e impactos.
Câncer continua a ser o principal foco de desenvolvimento de medicamentos com 36% de novos tratamentos aprovados em 2024.
BLOG CIENP
Fabiana C. V. Giusti, PhD; Sara Tolouei, PhD e João B. Calixto, PhD
2/20/20256 min read
Em 2024, as principais autoridades reguladoras de medicamentos - a FDA (Administração de Alimentos e Medicamentos) dos Estados Unidos, a EMA (Agência Europeia de Medicamentos) e a MHRA (Agência Reguladora de Medicamentos e Produtos de Saúde do Reino Unido) - continuaram a desempenhar um papel importante na aprovação de novos tratamentos, ampliando as opções terapêuticas para diversas condições de saúde. No ano passado, essas três agências aprovaram 53 novos medicamentos, um número inferior ao de 2023, quando foram autorizados 70 novos medicamentos. No entanto, as aprovações para medicamentos órfãos permaneceram próximas aos níveis de 2023, com 21 aprovações em 2024, em comparação com 24 no ano anterior. Esse dado reforça o compromisso contínuo das agências com o avanço das terapias para doenças raras e condições difíceis de tratar.
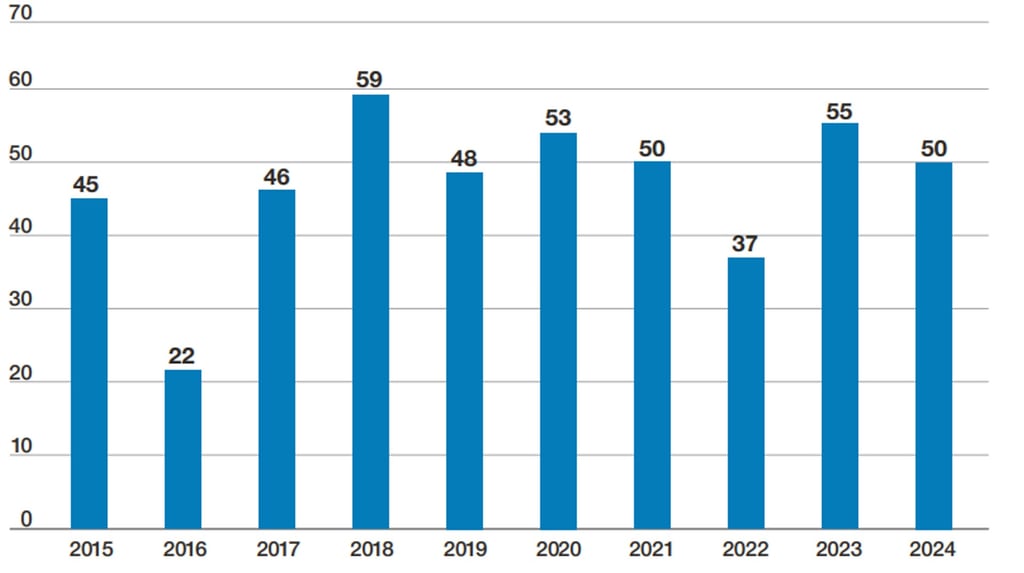
A análise das aprovações realizadas por cada agência em 2024 revela a predominância da FDA no cenário global. A agência americana foi responsável pela aprovação de 50 dos 53 novos medicamentos autorizados, reafirmando sua liderança na análise e aprovação de terapias inovadoras. É importante destacar, no entanto, que em 2023 a FDA aprovou um número maior de medicamentos evidenciando uma ligeira queda nas aprovações em 2024 (Figura 1). Mesmo assim, a FDA continua sendo a principal responsável pela introdução de novos tratamentos no mercado global.
Fonte: Conselho Federal de Farmácia, 2024.
Figura 1. Número de medicamentos aprovados pela FDA nos últimos dez anos.
Fonte: FDA - Center For Drug Evaluation and Research (CDER), 2025.
A EMA, por sua vez, aprovou 9 novos medicamentos, o que reflete seu processo mais rigoroso de avaliação de segurança e eficácia, adotando uma postura cautelosa em alguns casos. Já a MHRA aprovou 5 medicamentos, mantendo um número mais moderado de autorizações, mas ainda seguindo diretrizes internacionais e implementando processos próprios de análise. Essas diferenças nas aprovações mostram como as abordagens regulatórias e as estratégias adotadas por cada agência impactam diretamente a velocidade e a disponibilidade de novos tratamentos nos mercados onde atuam.
Além das variações no número de aprovações, outro aspecto relevante é a maneira como cada agência conduz seus processos regulatórios, o que pode impactar o tempo e a taxa de aprovação dos medicamentos. A diferença entre as três agências pode ser explicada por vários fatores, como as estratégias adotadas pelas empresas farmacêuticas na escolha dos mercados para submissão de seus pedidos, bem como as particularidades dos processos de cada agência. Além disso, a decisão final sobre a aprovação pode depender de comitês especializados, cujos critérios de avaliação podem variar conforme a instituição.
Um exemplo notável dessa divergência nas aprovações foi o caso do anticorpo monoclonal lecanemab (Leqembi), utilizado no tratamento do Alzheimer. A FDA autorizou o medicamento em 2023, seguida pela MHRA em 2024. A EMA, inicialmente, negou a aprovação devido a preocupações com os riscos adversos associados principalmente do anticorpo contra a beta amiloide no cérebro, que incluem inchaço cerebral e hemorragias. Essas preocupações resultaram em restrições no uso do medicamento em alguns países, como o Reino Unido. Contudo, em novembro de 2024, a EMA reviu sua posição e passou a recomendar a aprovação do Leqembi na União Europeia, evidenciando as diferentes abordagens adotadas por cada órgão regulador na avaliação dos riscos e benefícios dos novos tratamentos.
Em relação às inovações e à aceleração dos processos regulatórios, 2024 foi um ano marcado pela introdução de terapias inovadoras. No total, 24 medicamentos foram classificados como “first-in-class”, o que significa que esses tratamentos apresentam novos mecanismos de ação para tratar doenças de formas inéditas. Esse avanço simboliza o progresso do conhecimento científico e oferece novas possibilidades de tratamento para doenças complexas que, até então, não possuíam opções terapêuticas eficazes. Outro aspecto importante foi o uso crescente de programas de revisão acelerada pelas agências reguladoras. Aproximadamente 66% das aprovações em 2024 foram realizadas por meio de processos como o “Fast Track e o Breakthrough Therapy”, que aceleram a avaliação de medicamentos promissores e possibilitam que tratamentos urgentes cheguem ao mercado de maneira mais rápida. Tais programas têm sido fundamentais para garantir que pacientes com condições graves ou com poucas opções terapêuticas possam acessar novos medicamentos em tempo hábil.
Do ponto de vista regulatório, os medicamentos aprovados em 2024 pelas agências FDA, EMA e MHRA podem ser classificados em quatro categorias principais, com base na natureza do produto: moléculas pequenas (incluindo pequenos peptídeos), proteínas/anticorpos, produtos terapêuticos avançados (ATMPs, como oligonucleotídeos e produtos celulares/genéticos) e vacinas. Cada uma dessas categorias reflete diferentes abordagens terapêuticas e mecanismos de ação, e as novas drogas aprovadas em 2024 classificadas por categoria química/biológica estão apresentadas na Figura 2. Os novos medicamentos oriundos de pequenas moléculas ainda predominam entre as terapias aprovadas em 2024.
Figura 2. Medicamentos aprovados em 2024 pela EMA, FDA e MHRA classificados por categoria química/biológica.
Fonte: Novel drugs approved by the EMA, the FDA and the MHRA in 2024: A year in review. Br J Pharmacol, 2025.


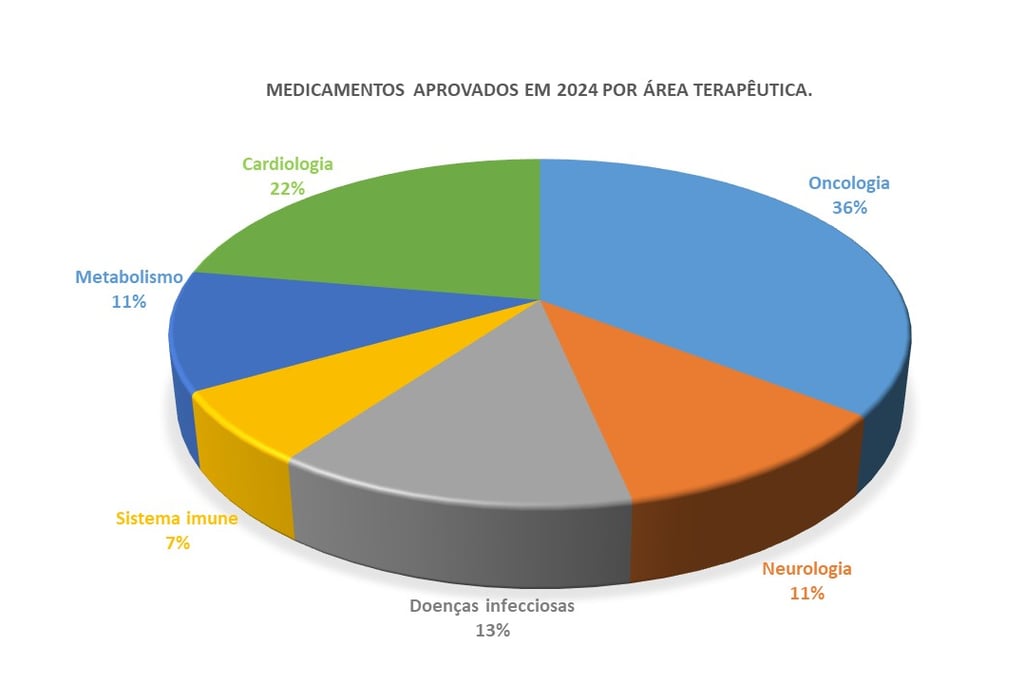
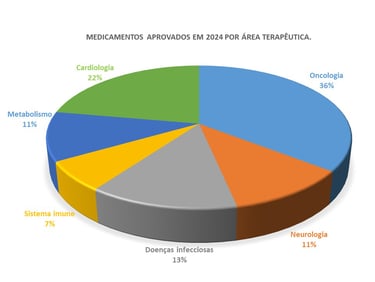
As aprovações de novos medicamentos em 2024, por área terapêutica, revelam um panorama de inovações em diversas condições médicas (Figura 3). O câncer foi uma das áreas mais destacadas, com vários medicamentos aprovados para o tratamento de diferentes tipos de câncer, como melanoma, câncer de pulmão e leucemias, refletindo a contínua evolução dos tratamentos oncológicos. Além disso, doenças infecciosas também representaram uma parte significativa das aprovações, com novos medicamentos direcionados a infecções virais, como a varíola dos macacos (mpox), destacando a importância das vacinas, como a JYNNEOS, no controle de surtos emergentes.
Outra área terapêutica notável foi a neurologia, com novos tratamentos aprovados para condições como a doença de Alzheimer e esquizofrenia, áreas com grandes necessidades médicas não atendidas. O medicamento Lecanemab para Alzheimer e Cobenfy para esquizofrenia ilustram os avanços significativos na farmacoterapia de doenças neurológicas, especialmente com medicamentos inovadores que agem por novos mecanismos de ação. Além disso, a hemofilia e o tratamento de doenças hematológicas também se destacaram, com a aprovação de Hympavzi, uma terapia que oferece uma nova opção de administração semanal para pacientes com hemofilia, melhorando o conforto, a eficácia e a adesão ao tratamento.
Na área de endocrinologia e metabolismo, 2024 viu a aprovação de terapias inovadoras para condições crônicas, como a esteatose hepática não alcoólica (NAFLD, do inglês Non-Alcoholic Fatty Liver Disease) e a doença hepática gordurosa não alcoólica avançada (NASH, do inglês Non-Alcoholic Steatohepatitis). Um destaque foi o Resmetirom, aprovado para o tratamento de NASH, uma condição progressiva que pode levar a complicações graves, como cirrose e câncer hepático. O Resmetirom oferece uma nova opção terapêutica para pacientes com essas doenças hepáticas, que frequentemente não possuem alternativas eficazes. A aprovação desse medicamento é um marco importante, pois representa um avanço no tratamento de condições metabólicas que têm se tornado cada vez mais prevalentes na população.
Figura 3. Medicamentos aprovados pela FDA, EMA e MHRA classificados por área terapêutica.
Em um cenário global de avanços terapêuticos, 2024 se revelou como um marco importante para a medicina, com novas terapias sendo aprovadas que prometem transformar o tratamento de diversas doenças. A diversidade de áreas atendidas, desde o câncer até distúrbios metabólicos e neurológicos, demonstra o esforço contínuo para responder às necessidades médicas não atendidas e oferecer novas alternativas para pacientes em situações críticas. Embora as aprovações tenham apresentado variações entre as agências, a constante inovação e a adoção de programas regulatórios acelerados são claras evidências de um futuro em que a ciência médica está se tornando mais ágil e eficaz, beneficiando milhões de pessoas ao redor do mundo. O caminho percorrido até aqui é promissor, mas o compromisso com a pesquisa e o desenvolvimento de novos tratamentos continua essencial para avançar ainda mais no enfrentamento dos desafios de saúde global.
Referências
FDA. Advancing Health Through Innovation: New Drug Therapy Approvals 2024. Disponível em: https://www.fda.gov/drugs/novel-drug-approvals-fda/novel-drug-approvals-2024.
Mullard A. 2024 FDA approvals. Nat Rev Drug Discov. 2025 Feb;24(2):75-82.
Topouzis S, Papapetropoulos A, Alexander SPH, Cortese-Krott M, Kendall DA, Martemyanov K, Mauro C, Nagercoil N, Panettieri RA Jr, Patel HH, Schulz R, Stefanska B, Stephens GJ, Teixeira MM, Vergnolle N, Wang X, Ferdinandy P. Novel drugs approved by the EMA, the FDA and the MHRA in 2024: A year in review. Br J Pharmacol. 2025 Feb 19.
Endereço
Av. Luiz Boiteaux Piazza, 1302 - Sapiens Parque, Cachoeira do Bom Jesus, Florianópolis, Santa Catarina, Brasil.
Segunda a sexta-feira das 08:00 às 17:00 horas.
©2024 - Centro de Inovação e Ensaios Pré-Clínicos
Mapa do site
Serviços
+55 (48) 3332-8400
contato@cienp.org.br
