Aprovações de medicamentos em 2023
Dados da atuação das principais agências regulatórias no último ano demonstram um número expressivo de aprovações, além de foco em doenças raras e inovação radical a todo vapor.
BLOG CIENP
Guilherme P. Fadanni, PhD e João B. Calixto, PhD
5/21/20245 min read


Após 3 anos de pandemia, 2023 foi o primeiro em que a COVID-19 perdeu o protagonismo nos esforços públicos e privados globais de saúde. Esse movimento se consolidou em maio quando o diretor da OMS chancelou a recomendação pelo fim do reconhecimento da COVID-19 como uma emergência de saúde pública de preocupação internacional. Agora, com o SARS-CoV-2 em segundo plano, as atenções voltam-se novamente a avanços tecnológicos e regulatórios mais amplos, os quais vêm sendo predominantemente associados nos últimos anos a doenças raras e ao desenvolvimento de produtos de terapia celular e gênica, terapias baseadas em RNA, anticorpos, e proteínas recombinantes.
Com base na análise dos dados liberados pelas agências regulatórias agora no início de 2024, o ano de 2023 não foi uma exceção à tendência indicada pelos anos anteriores, mas certamente impressiona com alguns dos números e marcos regulatórios alcançados. São exemplos o recorde histórico de aprovações da Food and Drug Administration (FDA), além das autorizações comerciais para o primeiro anticorpo anti-β-amiloide a ter sucesso (ainda que modesto) em estudos de fase 3 e o primeiro produto baseado em edição gênica por CRISPR-Cas9 a chegar ao mercado.
Para além da FDA
Principais referências:
European Medicines Agency (EMA). Human Medicines Highlights 2023. DIsponível em: https://www.ema.europa.eu/en/documents/other/human-medicines-highlights-2023_en.pdf
Food and Drug Administration (FDA). New Therapy Drug Approvals 2023. Center for Drug Evaluation and Research’s (CDER) 13th annual report. Disponível em: https://www.fda.gov/media/175253/download?attachment
Mullard, A. 2023 FDA Approvals. Nature Reviews Drug Discovery. Disponível em: https://www.nature.com/articles/d41573-024-00001-x
Papapetropoulos et al. Novel drugs approved by the EMA, the FDA, and the MHRA in 2023: A year in review. British Journal of Pharmacology. Disponível em: https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/bph.16337
Senior, M. Fresh from the biotech pipeline: record-breaking FDA approvals. Nature Biotechnology. Disponível em: https://www.nature.com/articles/s41587-024-02166-7
Os dados da FDA
A FDA continua sendo a protagonista entre as agências regulatórias, não somente pela importância do mercado norte-americano (cerca de 50% da receita mundial da venda de medicamentos) ou pelo efeito cascata que as aprovações da agência possuem, mas também pelo pioneirismo e pela capacidade de lidar com tecnologias de ponta para as quais não há muito conhecimento prévio e tampouco diretrizes regulatórias estabelecidas. Em 2023, o órgão estadunidense aprovou 71 novos medicamentos, o maior número da sua história. Destaque para a atuação do Center for Drug Evaluation and Research (CDER), setor responsável pela análise e aprovação de pequenas moléculas e alguns dos produtos biológicos, que fechou o ano com 55 novas aprovações (os detalhes você confere a seguir). Outro dado que merece destaque é o fato de que pelo segundo ano consecutivo a proporção de produtos biológicos entre as aprovações é próxima de 50%, uma provável consequência da evolução do portfolio das biotechs (Figura 1).
Se considerados os dados somente do CDER, a principal área das indicações terapêuticas continua sendo a oncologia, com 24% do total de autorizações. Em seguida vêm a neurologia (16%), as doenças infecciosas (9%) e a hematologia (9%). Quanto às modalidades terapêuticas, foram aprovadas 34 pequenas moléculas, seguido de 17 proteínas (sendo 8 anticorpos monoclonais, 6 anticorpos biespecifícos, 3 enzimas, 1 proteína de fusão e 1 hormônio) e 4 oligonucleotídeos (sendo 1 pequeno RNA de interferência, 2 oligonucleotídeos antisense e 1 aptâmero de RNA).
Embora não esteja computado nos dados acima, o Center for Biologics Evaluation and Research (CBER), também da FDA, contribuiu de maneira importante com novas autorizações para terapias celulares, terapias gênicas, hemoderivados e vacinas. Entre essas destaca-se a aprovação do Casgevy, o primeiro produto baseado em edição gênica por CRISPR-Cas9 a receber autorização comercial. Outras aprovações do CBER você encontra aqui.
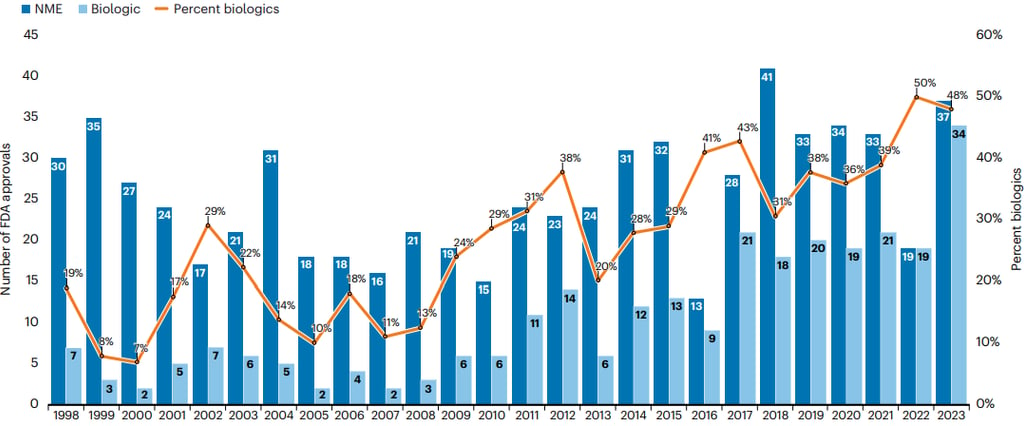
Figura 1. Número de aprovações de medicamentos pela FDA (CDER e CBER) de 1998 a 2023. Fonte: Nature Biotechnology.
Como de costume, todo ano o CDER disponibiliza uma relatório sobre suas atividades que você confere na íntegra clicando aqui. Para facilitar, estes são os principais destaques:
28 das 55 aprovações (51%) são produtos designados como "drogas-órfãs";
20 das 55 aprovações (36%) são produtos first-in-class;
36 das 55 aprovações (65%) utilizaram pelo menos um mecanismo de aceleração da análise regulatória (fast track, breakthrough therapy, priority review ou accelerated approval).
Apesar de algumas diferenças, é esperado que os números e características dos dados da FDA sejam razoavelmente reproduzidos em outras agências, como a EMA. Ao todo, a agência europeia concedeu 77 "opiniões positivas", que não refletem as aprovações propriamente ditas mas sim as recomendações favoráveis a serem julgadas posteriormente pela Comissão Europeia. Nesse número — que inclui genéricos, biossimilares e outros — há 17 drogas órfãs, além de 1 produto de terapia avançada já mencionado, o Casgevy.
Em uma análise de março deste ano, Papapetropoulos et al. (2024) compilaram os dados de 2023 da EMA, FDA e também da Medicines and Healthcare Products Regulatory Agency (MHRA), do Reino Unido (Figura 2). Segundo os autores, são 70 aprovações ao todo, sendo 37 pequenas moléculas e peptídeos (53%), 16 anticorpos e proteínas (23%), 11 produtos de terapia avançada ou baseada em RNA (16%), e 6 vacinas (9%). O número geral de first-in-class encontrados foi 30 (cerca de 43%), uma proporção ainda maior do que a demonstrada no relatório específico da FDA.
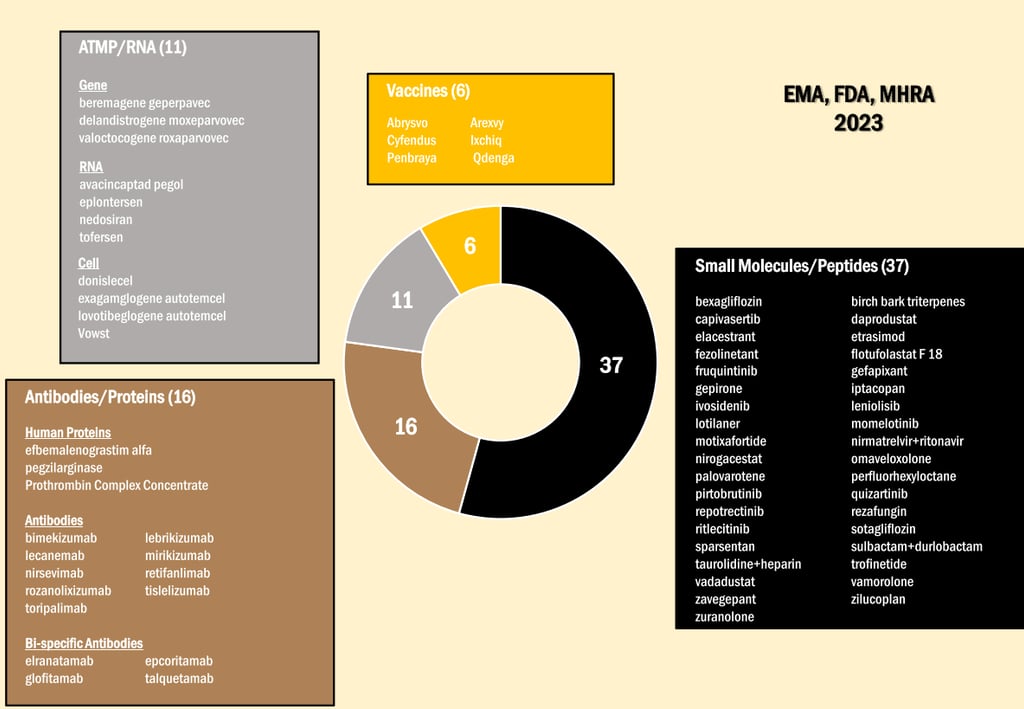
Figura 2. Compilado de aprovações da EMA, FDA e MHRA em 2023. Fonte: Papapetropoulos et al. (2024).
Assim como destacado inicialmente, os autores deste trabalho concluem que a maior parte das aprovações está associada a doenças raras ou outras condições para as quais não há terapias eficazes. No entanto, os autores também chamam atenção ao fato de que isso ocorre em contraste com as poucas aprovações para doenças cardiovasculares, doenças psiquiátricas e a dor crônica, condições que acometem grandes proporções da população mundial.
E como nem só de aprovações vivem as agências regulatórias, há espaço também para destaques entre as rejeições (Figura 3).
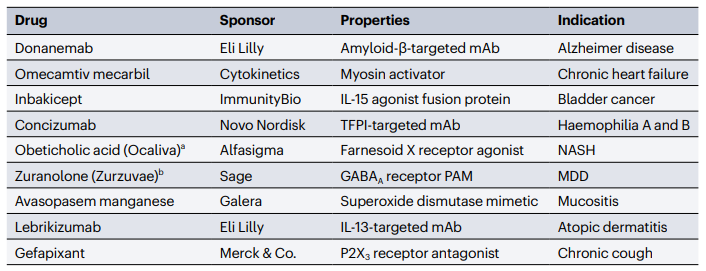
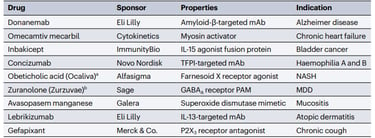
Ao contrário do desfecho positivo para o concorrente lecanemab, os primeiros resultados do anticorpo anti-β-amiloide donanemab não foram suficientes para convencer a FDA. Isso levou à rejeição do pedido de aprovação acelerada baseado em resultados de um estudo de fase 2. Em 2024, agora com estudos de fase 3 concluídos, a atualização mais recente é a de que a FDA postergou a análise e está formando um comitê independente para auxiliar na decisão. Já entre as outras rejeições, destacam-se a zuranolona (Zurzuvae), um anti-depressivo previamente aprovado para depressão pós-parto mas que falhou na tentativa de expansão para o transtorno depressivo maior, e o ácido obeticólico (Ocaliva), cuja rejeição para esteatose hepática não-alcóolica (NASH) deixa o caminho livre para o recentemente aprovado resmetirom (Rezdiffra).
Figura 3. Principais rejeições de autorização comercial pela FDA em 2023. Fonte: Nature Reviews Drug Discovery.
Endereço
Av. Luiz Boiteaux Piazza, 1302 - Sapiens Parque, Cachoeira do Bom Jesus, Florianópolis, Santa Catarina, Brasil.
Segunda a sexta-feira das 08:00 às 17:00 horas.
©2024 - Centro de Inovação e Ensaios Pré-Clínicos
Mapa do site
Serviços
+55 (48) 3332-8400
contato@cienp.org.br
